Nel 1996 la pecora Dolly ha aperto la strada alla clonazione animale da cellule somatiche, eppure ad oggi è stato commercializzato un solo animale geneticamente modificato a scopo alimentare, il salmone AquAdvantage a crescita rapida, mentre pochi altri animali GM vengono utilizzati per testare la funzione e la regolazione dei geni.
A livello nazionale la metodologia dell’editing genomico è stata utilizzata per lo studio, a scopo di ricerca, di una malattia neurodegenerativa nei suini e per l’eliminazione di molecole antigeniche presenti nei prodotti di origine animale sia in suini che nei bovini.
Il gruppo di ricerca del CREA- Zootecnia e Acquacoltura spiega le ragioni di natura tecnica, normativa, economica ed etica connesse con i lenti progressi in questo ambito.
Lo sviluppo e l’utilizzo di nuove tecniche genomiche (NTG, come definite dalla Commissione Europea) potrebbe essere uno strumento molto potente per contribuire alla trasformazione globale degli allevamenti, poiché tale tecnologia è in grado di accorciare significativamente il ciclo di allevamento, ridurne i costi e aumentare rapidamente la diversità genetica.
I sistemi di editing genomico consentono di introdurre modificazioni genetiche, ma, a differenza di tecnologie già esistenti, non comportano necessariamente l’introduzione di sequenze di DNA in nuove posizioni del genoma; in pratica si interviene direttamente sul gene già presente introducendo, a seconda dei casi, mutazioni casuali o mirate per ottenere gli effetti desiderati, sfruttando i meccanismi naturali di riparazione dei danni del DNA.
Quali sono le nuove tecniche genomiche nell’ambito zootecnico e come vengono utilizzate?
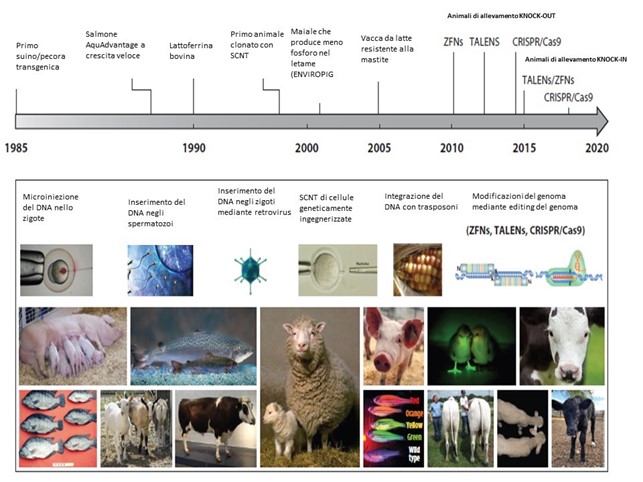
Le più recenti tecnologie, utilizzate anche nei processi di manipolazione del genoma, sono preferenzialmente tre: TALEN (Transcription activator-like effector nucleases), ZFN (Zinc-finger nucleases) e CRISP/Cas9 (CRISPR (Clustered Regularly Interspaced Short Palindromic Repeat)-associated protein 9). In tutti questi sistemi, ad una proteina che è in grado di introdurre tagli nel DNA (forbice molecolare), viene associato un “selettore” molecolare, capace di indicare alla nucleasi dove tagliare e di introdurre i cambiamenti in una specifica sequenza.
Sono stati già prodotti diversi animali d’allevamento con la tecnica dell’editing genomico, a scopo di ricerca, sia in campo biomedico che in agricoltura.
A livello mondiale, tra gli animali modificati a scopi produttivi risultano i seguenti: suini resistenti al virus della sindrome riproduttiva e respiratoria (gene CD163); bovini, pecore, capre, polli con una maggiore muscolatura (gene MSTN), pecore che producono più lana (gene FGF5); suini in cui viene soppresso lo sviluppo del testicolo nelle creste gonadiche fetali, con conseguente sviluppo dei caratteri femminili e perdita del forte odore del verro (gene KISS1); galline ovaiole, in cui si riesce a determinare il sesso delle uova, grazie all’introduzione di una proteina fluorescente sul cromosoma Z (determina il sesso maschile) delle cellule germinali. Le vacche che nascono senza corna (gene POLLED) sono un esempio di sostituzione intraspecie di uno dei due alleli del gene, mentre le vacche con una maggiore resistenza alla tubercolosi (gene NRAMP1) rappresentato il risultato di inserzione di un gene intraspecie (la cis-genesi). Complessivamente le modificazioni ottenute in animali di allevamento di cui si hanno riferimenti bibliografici sono circa quaranta.
A livello nazionale la metodologia dell’editing genomico è stata utilizzata per lo studio, a scopo di ricerca, di una malattia neurodegenerativa nei suini (gene SURF1) e per l’eliminazione di molecole antigeniche presenti nei prodotti di origine animale sia in suini che nei bovini (geni GGTA1 e CMAH).
Cosa limita l’utilizzo dell’editing genomico negli animali?
L’utilizzo dell’editing nel miglioramento genetico è attualmente limitato da due principali ordini di considerazioni: da un lato, è necessario conoscere i geni che devono essere oggetto della modificazione e che controllano le caratteristiche zootecniche che si intende migliorare; dall’altro, l’incertezza normativa che ancora permane non consente di chiarire se, per l’editing del genoma, si debba applicare la normativa esistente per gli organismi geneticamente modificati (OGM).
Non esiste un consenso tra le agenzie di regolamentazione a livello mondiale e la mancanza di armonizzazione ha portato a importanti differenze tra i Paesi. L’Unione Europeadefinisce OGM un organismo in cui il materiale genetico (DNA/RNA) sia stato alterato in un modo che non avviene solitamente mediante accoppiamento e/o ricombinazione naturale [European Council, (1990), (EU Directive No 2001/18/EC]. Attualmente, nell’UE, gli OGM devono essere sottoposti a una valutazione della sicurezza, secondo le disposizioni previste dalla legislazione, prima di essere autorizzati al consumo umano. La valutazione scientifica del rischio è delegata all’EFSA, che fornisce pareri scientifici sulla base di dossier dettagliati. Una valutazione effettuata nel 2021, ha chiarito che gli organismi ottenuti attraverso nuove tecniche genomiche sono soggetti alla legislazione sugli OGM.
Per le piante il discorso sembrerebbe più facile: una recente valutazione dell’EFSA ha concluso che le tecniche di “editing del genoma” delle piante non comportano maggiori rischi rispetto al breeding convenzionale o alle tecniche di mutagenesi e cisgenesi mirate.
In campo animale c’è ancora incertezza normativa. Infatti, mentre le colture vegetali geneticamente modificate sono commercializzate da oltre 22 anni, solo nel 1996 la pecora Dolly ha aperto la strada alla clonazione animale da cellule somatiche. Ad oggi un solo animale geneticamente modificato a scopo alimentare, il salmone AquAdvantage a crescita rapida, è stato commercializzato e pochi altri animali GM vengono utilizzati per testare la funzione e la regolazione dei geni (al di fuori degli studi sugli xenotrapianti).
Alcuni paesi applicano un criterio ragionevole secondo cui, se non esiste una “nuova combinazione di materiale genetico” e il prodotto finale è privo di “transgeni”, allora quel prodotto non sarà soggetto alla stessa regolamentazione di un OGM. Gli Stati Uniti applicano questo principio per l’editing del genoma nelle piante, tuttavia, sempre negli USA il criterio è l’esatto opposto per gli animali, soggetti a regolamenti stabiliti per gli animali transgenici: sono trattati, cioè, ai sensi del sistema di regolamentazione dei farmaci, lo stesso che, in sostanza, sta chiudendo la ricerca e l’applicazione futura di questa tecnologia.
D’altra parte, molti paesi in Sud America (tra cui Argentina e Brasile), Asia Orientale (si pensi al Giappone), Medio Oriente (ad esempio, Israele) e Oceania (ad esempio, Australia) hanno regolamentazioni più appropriate in base al tipo di evento da valutare. La Cina non ha definito uno status normativo specifico per i prodotti di modifica del genoma, ma vanta il numero più alto di pubblicazioni di ricerca e brevetti per applicazioni agricole del CRISPR.

Editing genomico ed Etica
L’inarrestabile progresso di CRISPR/CAS9 e la sua adozione non sono esenti da problemi di ordine pratico, economico ed etico. Dal punto di vista tecnologico, non si è ancora giunti all’assoluta precisione, per cui il rischio di creare modifiche non volute, che potrebbero comportarsi potenzialmente da mutazioni, è reale. Dal punto di vista economico, esiste una “guerra dei brevetti” tra gli istituti pionieri nello sviluppo della tecnologia CRISPR/CAS9 a causa degli interessi in gioco e delle inestimabili possibilità di guadagno. Un’altra partita importantissima è quella che si gioca a livello etico. Le metodologie di ingegneria genetica applicate agli animali da allevamento sono molto diverse rispetto a quelle utilizzate per le piante perché queste ultime possono rigenerarsi dalle cellule somatiche, mentre gli animali possono svilupparsi solo dalle cellule germinali. L’uso a scopo di ricerca degli embrioni solleva problemi etici e di benessere nei vertebrati, poiché in un esperimento di ingegneria genetica (compreso l’editing genomico) sono necessari molti embrioni; quelli trasformati con la modifica desiderata e nessun apparente effetto indesiderato sono selezionati per l’impianto; ulteriori embrioni vengono persi durante la fecondazione e la gravidanza.
I due metodi principali per ottenere animali geneticamente ingegnerizzati sono il trasferimento nucleare di cellule somatiche (clonaggio) e l’iniezione citoplasmatica (iniezione pronucleare o microiniezione). Con la clonazione, cellule primarie di un animale adulto (ad es. fibroblasti) vengono ottenute in coltura cellulare e poi trasfettate con componenti CRISPR/CAS9 (ad es. trasfezione virale o elettroporazione). Dopo la selezione delle alterazioni del DNA desiderate, il nucleo della cellula somatica è fuso con una cellula uovo enucleata per creare un embrione vitale e contenente il genoma modificato.
La microiniezione, invece, comporta l’iniezione diretta del complesso per l’editing del genoma nel citoplasma di uno zigote. Tuttavia, la microiniezione ha basse efficienze di editing e comunemente si traduce in mosaicismo (una miscela di alleli modificati e non). A causa delle difficoltà che la microiniezione comporta, i metodi di clonazione sono ancora ampiamente utilizzati e comunque possono portare a difetti alla nascita, aborti e morte postnatale precoce. Pertanto, in particolare per i vertebrati animali, gli esperimenti di modifica del genoma comportano problematiche etiche e di benessere.
Presso le aziende sperimentali del CREA non sono ancora state sviluppate ricerche relative all’utilizzo delle metodologie dell’editing genomico sugli animali da allevamento, anche per le problematiche menzionate.
Per ottenere un animale “editato a livello genetico” sono necessari investimenti a livello di ricerca di base (laboratorio specialistico, strumentazioni, personale), mentre il CREA, istituzionalmente, affronta le grandi sfide del XXI secolo, con un approccio multidisciplinare e improntato al trasferimento tecnologico dei risultati della ricerca. Considerando le questioni riguardanti anche la regolamentazione, l’ambito etico e l’eventuale accettazione da parte del consumatore di prodotti di origine animali ottenuti con le nuove tecnologie genomiche, lo sviluppo delle TEA nell’ambito del CREA non è stato finora preso in considerazione. I pochi esempi di editing genetici a livello nazionale sono stati sviluppati da un’istituzione privata (Avantea).
La zootecnia in Italia
La zootecnia italiana conta oltre 6 milioni di bovini (di cui circa 1,8 milioni di vacche da latte), più di 9 milioni di suini, oltre 8 milioni tra pecore e capre e circa 150 milioni di polli, attestandosi come settore chiave dell’agricoltura nazionale, con la maggior capacità di generare ricchezza per il Paese. Tra i prodotti zootecnici alimentari, le carni rappresentano più del 60% del valore della produzione zootecnica mentre il latte oltre il 30%. La maggior parte della produzione proviene dal sistema intensivo concentrato nelle quattro regioni settentrionali: Piemonte, Lombardia, Veneto ed Emilia-Romagna.
A partire dagli anni ’70 del secolo scorso si è assistito nel nostro Paese ad una riduzione degli animali allevati, e al contemporaneo aumento della produttività per capo allevato.
Come si è riusciti ad ottenere animali più produttivi? Grazie al miglioramento genetico delle razze, al perfezionamento dell’alimentazione, all’adeguamento delle strutture di produzione, alla diffusione di pratiche sanitarie più efficaci, all’automazione e all’affermarsi di modelli di gestione più integrati e funzionali, e allo sviluppo di una zootecnia di precisione.
Quali sono le sfide che deve affrontare il settore della zootecnia nel mondo e in Italia?
In primis c’è la richiesta di aumentare la disponibilità di alimenti di origine animale (carne, latticini, uova) per aiutare a soddisfare le esigenze nutrizionali di una popolazione mondiale in crescita, di circa 9 miliardi di persone nel 2050 secondo le ultime proiezioni delle Nazioni Unite. Allo stesso tempo, i cambiamenti climatici influenzano molto le produzioni zootecniche e minacciano la biodiversità, richiedendo sempre più un approccio “ONE HEALTH”, in un’ottica integrata di promozione della salute dell’animale, dell’uomo e dell’ambiente.
Miglioramento genetico animale: passato-presente e futuro
Il concetto di miglioramento genetico è strettamente legato al fatto che l’uomo fin dai tempi della domesticazione ha voluto migliorare, nelle specie animali, caratteri relativi alla produzione (quantità e qualità), alla velocità di crescita, alla fertilità e resistenza alle malattie, e all’adattabilità dell’animale all’ambiente in cui viene allevato. Il tutto si basava sulla selezione naturale, senza alcuna conoscenza dei meccanismi dell’ereditarietà, scegliendo gli animali migliori e con le caratteristiche desiderate.
A partire da metà degli anni ’50, con la scoperta del DNA – materiale alla base della trasmissione dei caratteri tra le generazioni – per la selezione degli animali si è assistito ad un processo esponenziale che ha portato prima alla selezione genetica e poi a quella genomica. Sono stati sviluppati dei complessi calcoli statistici, che utilizzano enormi quantità di dati fenotipici (il carattere che osserviamo e che vogliamo migliorare) e genotipici (non un solo gene, ma l’intero genoma). Così il miglioramento genetico basato sulla selezione genomica è diventato sempre più preciso, e si è ridotto notevolmente il tempo necessario per ottenere il progresso genetico.
Cosa ci attende nel futuro? L’editing genetico, oggetto del presente articolo, rappresenta uno degli ultimi progressi lungo il continuum che tende a migliorare la precisione del processo di selezione.

Ricercatore CREA-Zootecnia e Acquacoltura
Le sue attività riguardano principalmente l’applicazione di metodiche di biologia molecolare, genetica, genomica, trascrittomica, bioinformatica per studi di biodiversità, e dei caratteri produttivi e funzionali ai fini del miglioramento genetico in diverse specie di animali domestici.
#lafrase Non smetterò di meravigliarmi dei meccanismi molecolari che regolano il funzionamento di ogni singola cellula.

Ricercatore CREA-Zootecnia e Acquacoltura
Le sue tematiche di ricerca si sviluppano nel campo del miglioramento genetico degli animali di interesse zootecnico. In particolare, la sua principale esperienza consiste nella applicazione delle scienze “OMICHE” allo studio del genoma animale per comprendere la rete di geni che regolano i numerosi fenotipi delle produzioni animali d’interesse economico e per studiare la biodiversità animale.
#lafrase “βίος (bíos): vita. Sono biologa fin da bambina, perché ho avuto sempre interesse a capire i fenomeni della natura e le leggi che li governano, e a studiare gli esseri viventi. La perfezione della natura mi lascia a bocca aperta.



